Cambiamento climatico, il responsabile della perdita di fosforo dal suolo agricolo
Dai sottoprodotti agroalimentari possibili soluzioni, ma le normative sono confuse e contraddittorie. A cura di Mario A. Rosato
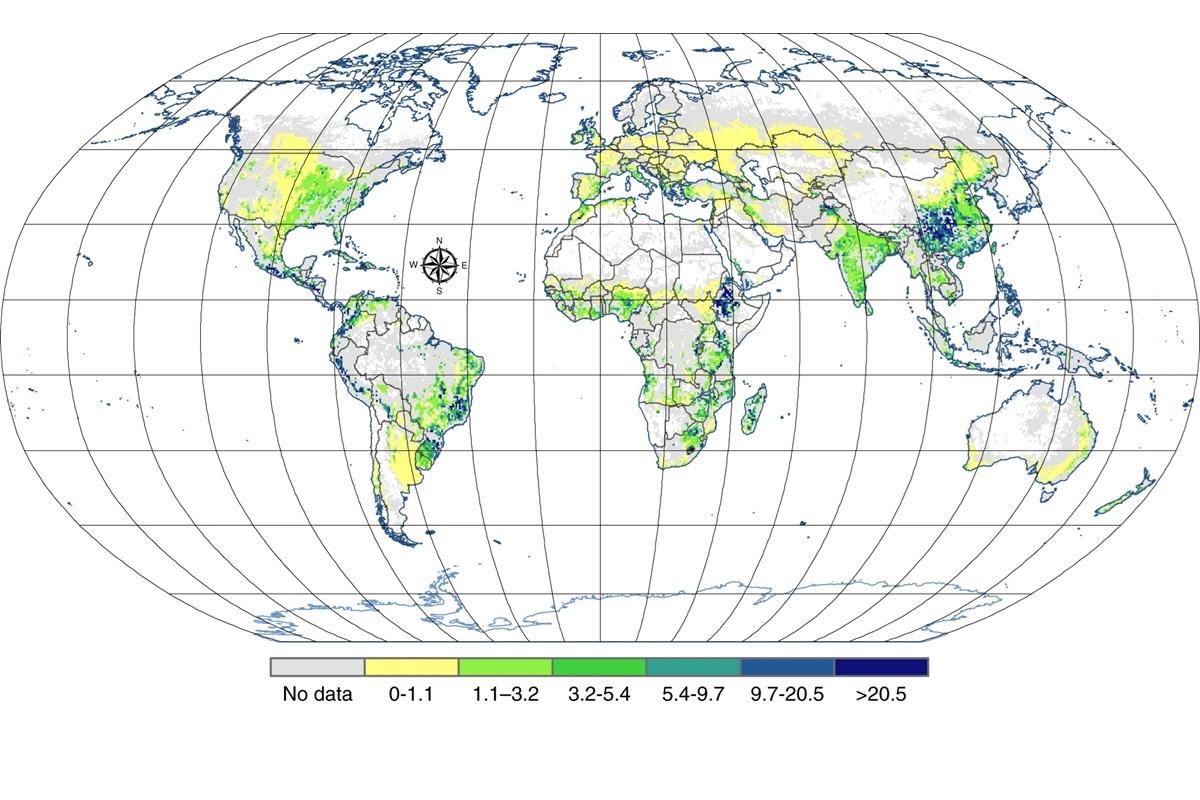
La perdita di fosforo globale causata dall'erosione. Osservare che Sicilia e Sardegna sono segnate in grigio per mancanza di dati, ma è probabile che la perdita di fosforo causata dalla progressiva desertificazione sia almeno uguale a quella rilevata nel Centro Sud Italia
Fonte immagine: Allewell et al. - Riferimento (1) nella bibliografia
Le discussioni degli esperti in geopolitica si concentrano spesso sull'importanza strategica dei giacimenti di terre rare, imprescindibili per le tecnologie avanzate, dai cellulari ai componenti per la transizione ecologica. L'autore ha già trattato l'argomento in un'altra sede in tempi non sospetti, scordando - mea culpa - che senza un'agricoltura sostenibile in grado di sfamare la crescente popolazione, a poco serviranno le supercar elettriche e i telefonini di ultima generazione.
Il fosforo è un elemento fondamentale per mantenere la fertilità dei suoli, ma è una risorsa finita al punto che l'Unione Europea ha creato una agenzia ad hoc per promuovere il suo riciclo. Il vecchio continente è ormai privo di fosfati e tutto il consumo europeo dipende dalle importazioni. Per questo motivo la Commissione Europea ha incluso il fosforo nell'elenco delle materie prime critiche (European Critical Raw Materials Act).
Il principale produttore mondiale (e detentore del 75% delle riserve) è il Marocco, dove le miniere di rocce fosfatiche sono monopolio del Gruppo OCP, monopolio statale insidiato da aziende statunitensi che ne vorrebbero una fetta. L'estrazione di fosfati è stata alla base del conflitto fra il Marocco e il territorio del Sahara Occidentale, ex colonia spagnola in mano ai ribelli del Fronte Polisario che ne rivendicano l'indipendenza.
Il secondo produttore mondiale è l'Egitto, seguito da Tunisia e Algeria e a lunga distanza da Cina, Brasile, India, Sudafrica, Russia e Stati Uniti.
È dunque chiaro che i fosfati diventeranno sempre di più una merce strategica come il petrolio o l'acciaio, in quanto la produzione agricola - e quindi la sicurezza alimentare - ne dipende direttamente.
Un recente studio cinese (2) indica il cambiamento climatico come il principale responsabile della perdita di fosforo dai suoli situati nelle fasce tropicali e subtropicali. In particolare, il problema è più acuto nel caso dei suoli agricoli, più soggetti all'erosione a causa delle lavorazioni. Il meccanismo di perdita del fosforo è direttamente legato agli eventi estremi di siccità e di piogge torrenziali, che dilavano il suolo accumulando i nutrienti - principalmente fosforo, potassio e azoto - nei corpi idrici. La maggiore concentrazione di nutrienti nell'acqua provoca la proliferazione di alghe, che sfocia nella morìa di pesci come quella avvenuta recentemente nella laguna di Orbetello e nelle emissioni di metano dal fondale diventato anossico, aumentando l'effetto serra e il cambio climatico, in un circolo vizioso difficile da spezzare.
Strategie come la pacciamatura, la coltura consociata e il sovescio possono rappresentare valide soluzioni per contenere l'erosione e conservare il fosforo, ma non ripristinano le quantità asportate con i raccolti. Inoltre, non tutto il fosforo presente nel suolo è accessibile alle piante. L'apatite è il minerale contenente fosforo più frequente nelle rocce fosfatiche. Si tratta di un minerale con composizione chimica variabile, genericamente rappresentata dalla formula bruta Ca5(PO4)3(OH,F,Cl). A seconda delle proporzioni di F, Cl e OH, il minerale può essere più o meno solubile e assimilabile dalle radici delle piante. Conseguentemente, il fatto che il fosforo sia presente in un suolo non garantisce la fertilità.
Il recupero del fosforo dai sottoprodotti agroalimentari
Esistono due possibili processi tecnologici che consentono di recuperare fosforo da scarti agroalimentari: la precipitazione di struvite dai liquami zootecnici e la produzione di acido fosforico da ossa animali.
Vediamo a grandi linee in cosa consistono tali soluzioni:
- La struvite è un minerale poco abbondante in natura. Il suo nome chimico è magnesio ammonio fosfato esaidrato, la formula chimica è H16MgNO10P. È lo stesso materiale che compone i calcoli renali. Poiché i liquami (e anche il digestato liquido) contengono N in stato ammoniacale e P come fosfati, l'aggiunta di magnesio e il gorgogliamento con aria provocano la precipitazione di cristalli di struvite di elevata purezza con tempi di reazione dell'ordine di 15 minuti. Con tale metodo, l'efficienza di recupero del fosforo da liquami suini può arrivare al 97,5% (3). La struvite era considerata rifiuto fino al 5 luglio 2021 perché si forma spontaneamente negli impianti di trattamento di acque fognarie e viene rimossa durante le operazioni di mantenimento. Dalla suddetta data può essere considerata ancora rifiuto oppure si applica la disciplina della "fine di rifiuto" in virtù del Regolamento Delegato (UE) 2021/2086 della Commissione del 5 luglio 2021, per cui diventa un prodotto fertilizzante a tutti gli effetti. L'aspetto interessante di questo processo è che recupera quasi tutto il fosforo e parte dell'azoto dei liquami, per cui la gestione di questo ultimo ai sensi della Direttiva Nitrati diventa più facile. Poiché c'è molto più N che fosforo nei liquami, è tecnicamente possibile spingere il processo con l'aggiunta di acido fosforico per eliminare le emissioni odorigene di ammoniaca e recuperare tutto l'azoto in forma di concime NP a lento rilascio. Attualmente l'acido fosforico (prodotto dalle rocce fosfatiche) è troppo costoso, per cui negli impianti di recupero di struvite ci si accontenta di recuperare solo il P e la frazione di N che reagisce con questo ultimo e con il Mg aggiunto, lasciando un effluente che contiene ancora N. Nel caso di un ipotetico impianto agricolo, una possibile opzione sarebbe il recupero dell'N residuale mediante la precipitazione di gesso o carbonato di defecazione.
Leggi anche Gessi e carbonati di defecazione
- I Sottoprodotti di Origine Animale (SOA) sono sottoposti alla vigilanza dell'autorità sanitaria, ma possono legalmente essere utilizzati per la produzione di energia, concimi e biodiesel. Le farine di ossa e carne trovano uno sbocco importante nella produzione di concimi organici e organo minerali grazie ai loro contenuti interessanti di azoto, fosforo e calcio (Tabella 1, tratta da 4). Il fosforo è maggiormente presente nella frazione ossea, in forma di idrossiapatite Ca5(PO4)3(OH). Questo minerale è più solubile rispetto alle rocce fosfatiche perché privo di F e Cl, quindi potenzialmente più efficace come concime.
Mentre l'utilizzo diretto come concime delle farine di ossa, o di ossa e carne, non presenta maggiori problemi burocratici quando queste sono prodotte con SOA Categorie 2 o 3, la gestione diventa giuridicamente complicatissima quando si tratta di recuperare fosforo (o altri prodotti d'interesse) da carcasse o carogne (rifiuti a tutti gli effetti). Il problema è dato dalla sovrapposizione di normative nazionali ed europee aventi definizioni contraddittorie (5).
Le carcasse animali (ad esempio di Categoria 1, di visoni o altri animali da pelliccia, di animali da sperimentazione), dovrebbero essere considerate "SOA non destinato a consumo umano" (si applica il Regolamento (CE) n.1069/2009 del Parlamento Europeo e del Consiglio del 21 ottobre 2009 recante norme sanitarie relative ai sottoprodotti di origine animale non destinati al consumo umano) perché rispondono alla definizione di "carcassa". Le carogne (animali selvatici o no, morti per cause naturali o accidentali, in stato di putrefazione o meno) dovrebbero essere considerate rifiuto, ma qui si apre una cervellotica parentesi sulle interpretazioni se siano "assimilati ai rifiuti urbani" e smaltiti come tali o se si debbano considerare "rifiuti pericolosi". Da un punto di vista puramente tecnologico, tali divisioni artificiose sono irrilevanti, in quanto il metodo più semplice ed efficace per la gestione di carcasse e carogne è l'incenerimento, con eventuale recupero dell'energia. In un processo di combustione tutta la materia organica - anche l'eventuale carico patogeno! - diventa CO2, vapore d'acqua, NO, NOx e SO2. Gli ultimi tre gas sono facilmente rimovibili con le normali tecniche industriali di trattamento fumi, e ciò che rimane è un inerte, la cenere. È interessante osservare come la cenere risultante dalla combustione di un corpo animale abbia una composizione chimica comparabile a quella delle rocce fosfatiche, per cui, invece di smaltirla come rifiuto (codice CER generico 190100 Rifiuti da incenerimento o pirolisi di rifiuti) sarebbe opportuno utilizzarla come materia prima per la produzione di acido fosforico e gesso. Il processo chimico è lento (alcuni giorni se condotto a temperatura ambiente) ma estremamente semplice.
La Foto 1 mostra un esperimento realizzato dall'autore nel proprio laboratorio. Per ogni ton di cenere di ossa la reazione renderà 530-670 litri di acido fosforico al 30-35% vol. e 1.715 chilogrammi di gesso. La qualità dell'acido fosforico è quasi identica a quella del prodotto industriale estratto da rocce fosfatiche, per cui l'implementazione di questo processo si potrebbe abbinare a quella descritta per la struvite, in modo da recuperare tutto il fosforo e tutto l'azoto dai liquami zootecnici e digestato liquido.
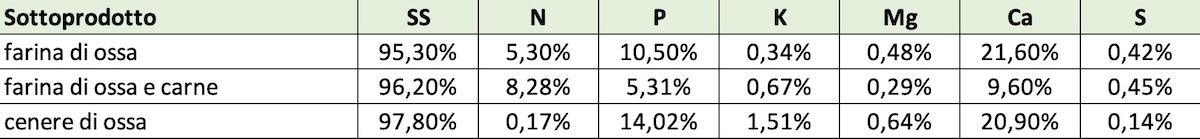
Tabella 1: Concentrazioni elementari espresse in percentuale di sostanza secca
(Fonte foto: Traduzione e adattamento grafico di Mario A. Rosato - AgroNotizie®)

Foto 1: Ossa calcinate a 600°C e soluzione di acido fosforico ottenuto dalle stesse
(Fonte foto: Mario A. Rosato - AgroNotizie®)
Il Decreto Legge 25 giugno 2024, n. 84 "Disposizioni urgenti sulle materie prime critiche di interesse strategico", entrato in vigore il 26 giugno 2024, non contiene alcun riferimento diretto al recupero del fosforo, bensì si focalizza sul riciclaggio di ferraglia, recupero di materiali strategici dalle batterie e riciclo degli scarti di miniera.
Bisognerà aspettare ancora regolamenti attuativi e l'entrata in funzionamento dei vari enti preposti definiti nel provvedimento per capire se esista una possibilità concreta di implementare filiere agricole di recupero dei fosfati. Magari con qualche semplificazione normativa rispetto alla giungla attuale di leggi e regolamenti.
Bibliografia
(1) Alewell, C., Ringeval, B., Ballabio, C. et al. Global phosphorus shortage will be aggravated by soil erosion. Nat. Commun. 11, 4546 (2020).
(2) Licheng Guo et al., Acceleration of phosphorus weathering under warm climates. Sci. Adv.10, eadm7773(2024). DOI:10.1126/sciadv.adm7773.
(3) Huang, H., Liu, J. & Jiang, Y. Crystallization and precipitation of phosphate from swine wastewater by magnesium metal corrosion. Sci Rep 5, 16601 (2015).
(4) Kurt Moller, Assessment of Alternative Phosphorus Sources for Organic Farming: Meat and Bone Meal. Pubblicazione dell'Università di Hohenheim.
(5) Giovanni Tapetto; Rifiuti.Considerazioni sulla gestione dei corpi di animali morti; Lexambiente Rivista giuridica a cura di Luca Ramacci - ISSN 2499-3174; 2020.